想當年,接觸Western Blot的時候也是一頭霧水,請教實驗室的前輩們,摸老半天,發現和自己的實際狀況仍搭不上邊......(暈)就這樣,決定自己親自探索這條科(不)研(歸)路。
你是否也有摸不著頭緒的狀況呢?來,這些是我根據ABclonal公司多年的國外研發團隊實戰經驗整理出來的WB實驗精華,大方送給共患難的你啦!
◆◆◆◆實驗流程◆◆◆◆
A.實驗原理WB(Western Blot)即蛋白轉漬法,其原理是通過特異性抗體對電泳處理過的細胞或生物組織樣品進行著色。通過分析著色的位置和著色深度獲得特定蛋白在所分析的細胞或組織中的表達情況的訊息。
Western Blot一般由樣本處理、凝膠電泳、樣品的轉漬和免疫學檢測組成。
1. 樣本製備
WB中檢測樣本來源主要是細胞、組織、微生物、植物等蛋白樣本;在WB檢測中,樣本中蛋白提取的是否充分,在整個WB檢測中非常的重要。樣品提取的方法常見的為機械法、物理法和化學及生物化學方法。a:機械法
* 高速組織搗碎機(轉速可達10000rpm,具高速轉動的鋒利的刀片),用於動物內臟組織的破碎;
* 玻璃勻漿器(用兩個磨砂面相互摩擦,將細胞磨碎),適用於少量材料,對細胞破碎程度較高速搗碎機高,機械切力對分子破壞較小
b:物理法
反覆凍融法、冷熱交替法、超聲波法、加壓破碎法
c:化學及生物化學方法
* 有機溶媒法、自溶法、酶法、表面活性劑處理;
* 樣本經過處理後,使樣本中的蛋白能夠解離出來,用於後續的檢測;
* 現在常用的提取方法是以上幾種方法聯用,最常見的就是RIPA裂解液。其中根據蛋白性質的不同,我們選擇的裂解液也不一樣。
裂解液的比較:
1、用於普通的Western、IP或co-IP,我們推薦使用Western及IP細胞裂解液,裂解細胞或組織後,沒有非常黏滯的透明狀DNA團塊形成,不必採用超聲處理等就可以非常理想地用於後續操作。另外裂解的產物也適合用於磷酸化蛋白的Western檢測。
2、對於某些特殊蛋白的IP,如果發現Western及IP細胞裂解液效果不是非常理想,可以用RIPA裂解液(強、中或弱)或NP-40裂解液。如果發現IP的時候背景值很高,即非特異的蛋白也被IP下來,則需要選用裂解強度較高的裂解液,例如RIPA裂解液(強或中)。如果發現目標蛋白無法被IP下來,則說明裂解液的強度過強,可以使用較弱的裂解液例如RIPA裂解液(弱)或NP-40裂解液。
3、對於某些難溶解蛋白的Western,如果發現Western及IP細胞裂解液效果不是非常理想,可以嘗試使用裂解強度更高的裂解液例如RIPA裂解液(強、中)或SDS裂解液。
樣品製備完,應立即低溫保存「-20℃短期(幾天)」;-80℃長期;例外,IP用樣品應直接進行IP,避免凍融破壞蛋白質間的相互作用。在樣品製備過程中,另一個需要注意的問題是,從樣品製備的起始階段就要注意定量問題;WB本身誤差有20%,太細微的差別經常忽略不計。組織樣品,從腫瘤組織的大小(稱重)開始,裂解液的體積都是精確定量的,操作過程也盡量避免蛋白損失。
2. SDS 聚丙烯酰胺凝膠電泳(SDS-PAGE)
基本原理:凝膠由兩種不同的凝膠層組成。上層為濃縮膠,下層為分離膠。濃縮膠為大孔膠,緩衝液pH6.8,分離膠為小孔膠,緩衝液pH8.8。
電泳時,loading順序需要提前做好設計,空的泳道需要上等體積的1X loading buffer。通常是恆壓電泳,具體電壓根據各自儀器的不同而略有差異,但不要太高。另外也要避免樣品間濃度差異過大、鹽濃度過高、太過黏稠、有不溶的顆粒物、膠孔不齊。
根據蛋白分子量大小的不同,選擇不同濃度的分離膠用於實驗。
3. 轉漬
基本原理:
SDS-PAGE中的蛋白帶有負電,在電場的作用下,帶負電的蛋白會轉移到膜上。即把凝膠中已分成band的蛋白質轉移到一種固相載體上,用得最多的材料是硝酸纖維素膜(NC 膜)和聚偏二氟乙烯(PVDF 膜),蛋白轉移的方法多用轉移電泳。
SDS-PAGE中的蛋白帶有負電,在電場的作用下,帶負電的蛋白會轉移到膜上。即把凝膠中已分成band的蛋白質轉移到一種固相載體上,用得最多的材料是硝酸纖維素膜(NC 膜)和聚偏二氟乙烯(PVDF 膜),蛋白轉移的方法多用轉移電泳。
方法選擇:半乾轉法or濕轉法?
轉漬方法一般有半乾轉法和濕轉法。兩者原理完全相同,只是用於固定膠/膜疊層和施加電場的機械裝置不同。濕轉適合所有的蛋白,轉漬效率最佳,但耗費試劑、溶液,對普通分子量大小的蛋白轉染操作時間長於半乾轉(下文會具體給出條件);半乾轉適合分子量較小的蛋白,省時、省試劑。蛋白分子大小界定習慣上認為100kda以上為大蛋白,其他均屬於小蛋白,當然這只是一個相對標準。因此,通常對大蛋白的轉漬多數人會選擇長時程的濕轉。
實際上用半乾轉緩衝液進行濕轉效果也非常理想,通常這種緩衝液可以反覆使用多次(<=5次常規1hr電轉,如有3hrs長時程轉染,緩衝液使用次數會減少),不過要注意初始電流(同樣溫度下,初始電流高,表明緩衝液中電解質剩餘不多,為確保轉漬溫度,可開始或中途更換新緩衝液)。電解液中SDS增加蛋白的水溶性,促進蛋白在電解液中泳動。若不加SDS,蛋白會沉澱在膠上,但SDS過多會影響蛋白與膜的吸附。甲醇能使SDS與蛋白分離,甲醇濃度越高SDS與蛋白分離越快,但高濃度的甲醇對蛋白會有固定作用,不利於蛋白從膠裡跑出來。一般來說甲醇的濃度為20%,但PVDF膜截留marker上交聯的小分子顏料的能力很差,可考慮提升甲醇的濃度至25%;大蛋白轉漬可考慮降低甲醇濃度。甲醇的另一個作用是降溫,舊的電解液由於電解質的消耗和甲醇的揮發,電解時電流或電壓變化更快、溫度升高也更快,因此可考慮增加額外的甲醇;這點對半乾轉緩衝液的意義較大,因為半乾轉緩衝液消耗很慢,緩衝液放置的時間較久,甲醇揮發比較嚴重,可臨時少量補加。
Tips:緩衝液的配製方法:39mMglycine2.9g, 48mMtris5.8g, SDS0.37g加入600ml去離子水,充分攪拌溶解。加去離子水將溶液定容至800ml後,加入200ml甲醇,室溫保存。有時,為降低實驗毒性,也可以將甲醇替換成乙醇,對實驗的影響不大。
轉漬溫度:
轉漬最好在低溫進行(高溫會局部溶膠或降低轉漬效率),儘管很多半乾轉儀沒有具體要求,但用預冷過的電轉液濕濾紙比未預冷的轉漬效率更高。因此,有條件建議濕轉、半乾轉均在低溫(4℃)進行。此外,濕轉緩衝液可以考慮轉漬前-20℃預冷,時間不能長於2hrs,否則電泳液凍結。
Transfer Sandwich的製作:
製作Transfer Sandwich的過程中,書中強調過濾紙、膠、膜的大小最好一致,否則沒有膠、膜隔開部分的濾紙會因為直接接觸而產生局部短路,降低內阻增加電流,造成升溫過快。但進口儀器隨廠原包裝附帶的濾紙有限,如果每次都切割新濾紙,消耗過快、初次使用的膜轉漬效率不高,且增加額外的操作。因此,實際上濾紙大一些也不太要緊,但是小編會選擇已經切割好的和膠面積最接近的濾紙;通常膜的大小會嚴格控制在與膠面積一致或略小一點點。操作時在保證每一層均無氣泡的前提下,疊好後再碾壓幾個來回,力道要均勻、恰好;力量過大,膠會被拉伸,band會扭曲、變形。碾壓的目的不是為了驅趕氣泡,更重要的作用是讓膜和膠貼得更緊密。可以理解的是,對於蛋白分子的大小而言,膠和膜之間的間距是數十萬倍計的,因此更緊密的接觸無疑是轉漬成敗的關鍵。Tips:半乾轉雖然速度快,但效果是不如濕轉的。觀察預染marker、轉漬後Coomassie Brilliant Blue G-250染色檢測凝膠可以幫你判斷轉漬效果。如果擔心轉過,可使用0.2μm孔徑的膜。轉漬會大量放熱,注意保持低溫;轉漬槽連續使用會有大量鹽在白金絲上析出,建議使用後用純水浸泡以維持正常的使用效果。
在轉漬過程中,膜的選擇非常重要。現在常用的膜有硝酸纖維素膜(NC)和PVDF膜。
硝酸纖維素(nitrocellulose, NC)膜:
NC膜與蛋白質靠疏水作用結合,不需預先活化,對蛋白質的活性影響小;非特異性本底顯色淺;價格低廉,使用方便。但小分子蛋白與NC膜結合力較差,洗滌時易丟失,同時NC膜韌性較差,易損壞;
聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜:
與蛋白質親和力高,使用前需在甲醇中浸泡,以活化膜上的正電基團,使其更容易與帶負電荷蛋白結合。
tips:實驗的注意事項
1.聚丙烯酰胺的30%原液會降解,要4℃避光保存。
2. APS會失效,10%APS一般保質期才一個月左右。 -20℃分裝長期保存。
3.注意Tris buffer的PH值,以及平時所用的水的PH值。 PH值改變會使band非常怪異,所有蛋白和溴酚藍壓成一條細線(即便在分離膠中),如果溴酚藍前有紅色染料,那麼此染料彗星式拖尾從溴酚藍一直延伸到膠底部。
4.上下層式電泳裝置若漏液,哪邊漏液,band往哪邊傾斜。內外式電泳裝置漏液,則裝置處於短路狀態,液體會過熱。 SDS-PAGE膠可能局部自溶,band扭曲、變形。
5.配膠用玻璃板和邊條應即時洗淨。
玻板未洗淨的壞處很多。儘管玻璃看似平滑,但是一些細微的凹陷處會凝結肉眼無法分辨的膠顆粒,其壞處是,在該部位極易導致不均勻的膠塊,樣品經過該處或電泳散熱不好,band變形。如果是RNA的超薄膠,膠板的顆粒會導致局部巨大氣泡,非常難於清除;蛋白膠也會導致一些小氣泡的產生。玻板沒洗淨的另一個壞處是,玻璃表面越光滑黏附越牢,未洗淨的玻板會削弱和膠體間的黏附力,拔comb或邊條時會產生微小的錯動,膠體下部出現大量氣泡(夾在玻板和膠之間,這個關係不大);嚴重的錯動會使loading時,樣品從膠和玻璃之間的間隙漏光,或者甚至膠和玻板分開。為避免拔comb時的錯動,可在電泳緩衝液中拔comb(比水更好,有SDS潤滑)。判斷玻板是否洗乾淨,用手摸一下有沒有疙疙瘩瘩的;最好用洗潔精之類,洗衣粉、肥皂都不好用。
6.loading時,不要把tip深入膠孔過深可能會錯開膠和玻板, 樣品會洩露。
7.增加loading量不一定會提高熒光信號強度。增加loading量的後果通常只能是讓你的內參抗體黏連,所有的蛋白band都扭曲變形。因為增加loading量最多只能提高幾倍,而WB靈敏度是以10的幾次冪量級的,所有目標蛋白信號的唯一方案就是IP富集(可特異提高目標蛋白濃度數百數千倍,並去除其它雜蛋白干擾)。增加loading量的另一個壞處是,本來高表達的蛋白,諸如內參抗體,在同樣WB條件下,可能出現熒光灼燒式粹滅(一晃而滅)或者band中空。
以6孔板80%以上匯合度為例,細胞裂解液通常都是投入200ul(最少80ul,這樣面積的培養板如果裂解液投入太少,回收時的損失就太大,loading就很難做到一致),而這種濃度條件下製備的樣品,電泳時loading量要控制在5-6ul,最少2.5ul,最多10ul,10ul時內參基本已經開始黏連成一條線,帶型出現波浪紋;當然並非不可以多loading,再多對WB最終的結果影響不大,且band都很醜。
8. SDS PAGE膠配好暫時不用時,需用電泳緩衝液灌滿空間(拔去comb和底邊邊條後的間隙),用保鮮膜包裹防止液體蒸發,短期室溫或稍長期4℃保存。個人習慣為,灌好分離膠用飽和的正丁醇灌滿上層,保鮮膜包裹,次日再灌堆積膠。兩種方案都可以。所以如果預計次日工作量較大,可以提前灌好SDS PAGE。
如何控制轉漬的效率呢?
最先考慮的應該是Ponceau S染色,來發現此操作不僅增加額外的操作時間,而且不能說明任何問題,於是拋棄之。
首先,Ponceau S(也包括Coomassie Brilliant Blue G-250染色)的靈敏度和HRP-ECL體系的靈敏度相差太遠,即使Ponceau S染膜無顏色,也無法提示WB結果會不會失敗(Coomassie Brilliant Blue G-250染色膠無顏色也不能說明轉漬充分了,除非你銀染),你仍然得繼續後面的操作;相反靶蛋白區域有顏色,亦無法提示靶蛋白就轉漬完全了,也許只是另外一個分子量大小相近的蛋白。因此,無論Ponceau S染膜失敗或成功,你都必須進行後續的操作。而Ponceau S染膠不僅增加額外的操作時間,而且增加一輪漂洗的操作,對膜和膜上的蛋白都不好。那麼為什麼不採用更直觀的預染marker做轉漬監控的依據呢?理論上,同時轉漬、顏色是交聯到蛋白上的,因此顏色有多深表明有多少蛋白轉漬到膜上,非常直觀、不會增加任何額外的操作(固定marker的loading量非常必要)。當然上面提到針對PVDF膜,由於對小分子截留的局限,顏料分子會在高強度的轉漬過程中從交聯的蛋白上脫落並穿過膜(顏料與蛋白交聯得過深會使整個lane糊掉;太緊(多)可改變蛋白構象使遷移率改變。所以多數情況下顏料和蛋白之間是一種不穩定的交聯,這意味著在某些條件下,顏料會從交聯的蛋白上脫落,又因為膜分子孔徑以及膜對不同物質吸附能力的差異,顏料小分子會輕易穿過膜到濾紙背面,而蛋白則被牢固的截留在膜上),造成轉漬過度的假象。現在你知道有這種局限,要不更換NC膜;要不採用上面提到的非常穩定的轉漬條件、注意必要的細節,就可從根本上忽略掉其對轉漬效率的指示,而把預染的marker僅僅作為一個分子量大小的指針,當然同時可確認之前的轉漬操作無誤 ,也可為後續抗體incubation時膜的正反面做必要的提示。
不同公司預染的marker效果不太相同,一般NEB和invitrogen的常規分子量預染marker要上8-10ul,MBI的只要5ul(膠大小20×30cm),Biorad-mini3型(8.2×7.4cm)MBI最低2.5ul轉漬後就足夠清晰。
4. 抗體檢測、顯色發光
基本原理:利用抗原和抗體的特異性反應,檢測目標蛋白;免疫檢測方法可以是直接的和間接的。現在多用間接免疫酶標的方法,在用特異性的第一抗體雜交結合後,再用酶標的第二抗體(鹼性磷酸酶(AP)或辣根過氧化物酶(HRP)標記的抗第一抗體的抗體)雜交結合,再加酶的底物顯色或者通過膜上的顏色或X 光底片上曝光的band來顯示抗原的存在。
A. blocking:
將轉漬膜取出,用去離子水清洗,TBST洗一次5 min後,加入3%的脫脂牛奶封閉,於室溫封閉1-1.5小時。洗膜1次,10 min;
B. 一抗incubation:
一抗(3%脫脂牛奶抗體稀釋液),4℃incubation過夜。洗膜3次,每次10 min;
C. 二抗incubation:
二抗濃度(3%脫脂牛奶抗體稀釋液),室溫incubation1-1.5h。洗膜3次,每次10 min。一般用的二抗都是HRP(辣根過氧化酶)標記的;
D. 顯影:
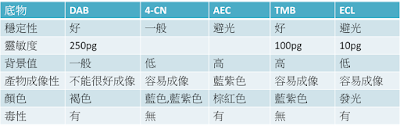
WB檢測中顯影的常用方法根據催化底物不同,可以分為化學發光法和底物顯色法;在WB檢測中,常用的酶是HRP(辣根過氧化酶)和AP(鹼性磷酸酶)。其中用的較多的是HRP。選用不同底物,出現的結果也不一樣。
這裡有你喜歡的文章:
磷酸化蛋白大補丸如何使用GEO資料庫ChIP-Seq數據和UCSC genome browser資料庫設計ChIP Primer?











沒有留言:
張貼留言